Investigación del Síndrome de Schaaf-Yang
Para comprender el Síndrome de Schaaf-Yang es esencial conocer la función del gen y el mecanismo de acción de las mutaciones
Hay varios organismos que están estudiando el Síndrome de Schaaf-Yang desde distintos ámbitos.
La Asociación Española del Síndrome de Schaaf-Yang colabora con la Universidad de Barcelona aportando fondos mediante un convenio de colaboración para el desarrollo de un proyecto de investigación sobre las bases moleculares del Síndrome de Schaaf-Yang así como la identificación de biomarcadores y la búsqueda de estrategias terapéuticas, que es llevado a cabo por el Grupo de Investigación de Genética Molecular Humana de la Universidad de Barcelona, bajo la dirección de la Dra. Balcells Comas, la Dra. Urreizti Frexedas y la Dra. Rabionet Janssen.
Por otro lado, la Fundación Prader Willi (USA) coordina distintos centros de investigación en la investigación del Síndrome de Prader-Willi y del Síndrome Schaaf-Yang. Algunas de sus líneas de investigación se resumen en su plan de investigación:
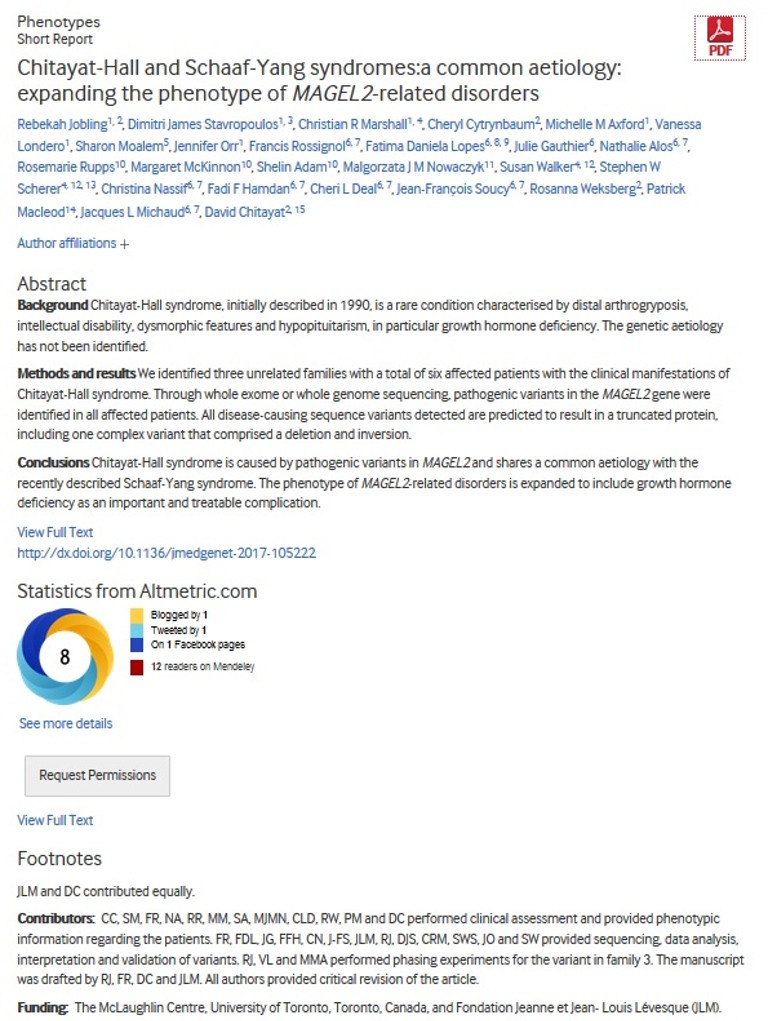
– El fenotipo caraterístico del Síndrome de Schaaf-Yang se debe a las mutaciones genéticas y, dado lo variable del fenotipo, se intenta caracterizar la correlación entre los distintos fenotipos con los genotipos producidos por la deleción, adición o sustitución de bases nitrogenadas en la región del cromosoma 15q11-13.
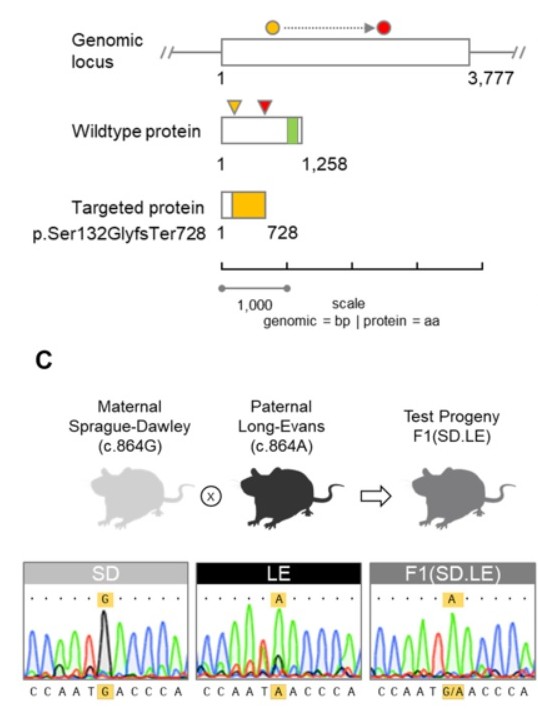
– Se están utilizando dos tipos de ratones con alteraciones en MAGEL2:
- – C57BL / 6-Magel2tm1Stw. Se usa para evaluar la acción de la dopamina, serotonina, las alteraciones del sueño, la respuesta reguladora a la hipoglucemia, la composición grasa/músculo y de la oxitocina. Se están evaluando posibles terapias con oxitocina, endocannabinoides, diazóxido, OEA y setmelanotida.
- – Magel2 tm1.1Mus. Este ratón tiene una mala lactancia, mayor mortalidad neonatal y retrasos cognitivos. Con el suministro de oxitocina, el ratón mejora de estos problemas.
- – Asimismo, el grupo de Muscatelli (Francia) está desarrollando dos nuevo modelos en ratones y el grupo del Baylor College of Medicine (USA) está desarrollando un nuevo modelo de rata.
– Gracias a estos estudios, la FDA ha aprobado o está estudiando el suministro varios medicamentos como la hormona de crecimiento, oxitocina y carbetocina en humanos.
Además, la Fundación ha aportado cantidades considerables de dinero en las siguientes investigaciones:

El Dr. Ryan Potts y su equipo, del Hospital de Investigación Infantil St. Jude (Memphis) han estudiado células neuronales primarias a partir de células madre de pulpa dental tomadas de «dientes de leche» desechados. Descubrieron que el reciclaje de vesículas está alterado en las células PWS y que esto es una consecuencia de la pérdida del gen MAGEL2. También describieron las diferencias en el desarrollo de las células de niños con PWS en comparación con los niños sanos.
Hasta ahora había habido dificultades para comprender el vínculo de MAGEL2 con PWS. Con este trabajo han demostrado que MAGEL2 funciona para prevenir la degradación aberrante de proteínas que normalmente residen en la membrana plasmática, a través de la modificación específica de otra proteína, llamada WASH que facilita el reciclaje de proteínas evitándolas de la degradación aberrante en el lisosoma.
En 2020 caracterizarán y cuantificarán estas diferencias, para no solo comprender cómo funcionan los genes PWS a nivel celular, sino también trabajar para desarrollar una plataforma para detectar fármacos que puedan ayudar a restaurar la función normal en las células PWS. También examinarán nuevas mutaciones en MAGEL2 informadas en individuos con fenotipos superpuestos con PWS y SYS, que no se han caracterizado previamente.

El Dr. Schaaf y su equipo, del Hospital Universitario de Heidelberg (Alemania), han examinado un modelo de ratón PWS/SYS, así como las neuronas generadas a partir de fibroblastos de la piel de individuos con SYS obtenidas (utilizando tecnología de células madre pluripotentes inducidas), y han encontrado una sobreactivación significativa de un importante vía celular llamada la vía «mTOR» que puede corregirse con un medicamento llamado rapamicina, que está aprobado por la FDA y ya está en uso para varias afecciones.
La rapamicina pudo rescatar varios de los déficits en las líneas celulares humanas de SYS.
La investigación científica básica realizada en líneas celulares generadas a partir de individuos con SYS puede conducir a estudios preclínicos y enfoques terapéuticos novedosos para SYS y PWS.
En 2020 estudiarán los efectos de la rapamicina en el modelo de ratón PWS / SYS, que está disponible públicamente y que muestra la regulación positiva de mTOR. En dos experimentos, evaluaremos los efectos prenatales y postnatales del tratamiento con rapamicina. Para nuestros experimentos, elegimos medidas de resultado fáciles de determinar y altamente cuantificables.
Si esta investigación determina un beneficio terapéutico de la rapamicina en el modelo de ratón de PWS y SYS, entonces el siguiente paso lógico sería un ensayo clínico de rapamicina en individuos con PWS y SYS. Dado el conocido perfil de seguridad y la aprobación de la rapamicina por la FDA, este sería un desarrollo bastante sencillo.

La Dra. Rachel Wevrick y su equipo de la Universidad de Alberta, estudian la función de la primera mitad de la proteína (llamada terminal «N») producida por el gen MAGEL2, ya que hasta la fecha, los investigadores sólo han estudiado la función de la segunda mitad de la proteína MAGEL2 (llamada terminal «C»).
Esta proteina es importante para el desarrollo normal del cerebro, los músculos o el sistema endocrino.
Recientemente han descubierto que el extremo N-terminal de la proteína MAGEL2 interactúa con un conjunto de proteínas importantes para la estabilidad de los ARNm, algunos de los cuales dan instrucciones para la producción de proteínas en las sinapsis de las neuronas.
Se cree que la mitad N-terminal de MAGEL2 se une a complejos que contienen ARNm, mientras que la mitad C-terminal controla la estabilidad de esos complejos a través de una función conocida de MAGEL2 en la ubiquitinación de proteínas. Esta actividad falta por completo en personas con PWS mientras que, en personas con SYS, la proteina parcial de MAGEL2 puede unirse a complejos que contienen ARNm pero no puede degradarlos.

El Dr. Deniz Atasoy y su equipo, de la Universidad de Iowa, descubrieron recientemente que la proteína MAGEL2 es importante en el papel que juega la oxitocina en la normal comunicación de las neuronas en el cerebro. Estas neuronas están involucradas en el comportamiento social, la cognición y la alimentación infantil. Este proyecto estudiará un modelo de ratón de PWS que carece de MAGEL2, para comprender cómo la pérdida de MAGEL2 afecta la comunicación de estas neuronas y cómo cambian los circuitos cerebrales cuando falta MAGEL2.
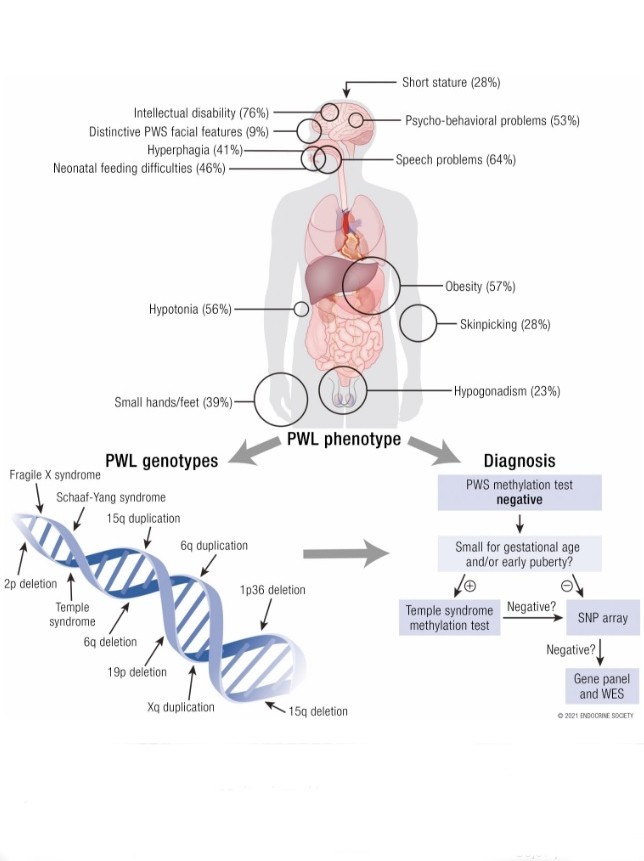
MAGEL2 es más activo en el cerebro, en los músculos, los cartílagos y los huesos, y en las glándulas suprarrenales. MAGEL2 es especialmente importante para mantener los ciclos normales de sueño y vigilia, para la fuerza muscular y la resistencia, y para las respuestas de hambre en partes del cerebro que controlan el apetito y el peso corporal.
Ya se descubrió que MAGEL2 interactúa con proteínas importantes para los ritmos diurnos y nocturnos, y con proteínas que faltan en niños con otras formas genéticas de discapacidad del desarrollo.
Se determinará si las células con defectos en MAGEL2 tienen defectos en las vías que descubrimos a través del análisis de la interacción proteína-proteína. Las terapias farmacológicas que se están probando en PWS tienen efectos beneficiosos en ratones que carecen del gen MAGEL2, mejorando su masa muscular y ósea, disminuyendo su masa grasa y reduciendo su apetito.

La Dra. Marnie Blewitt y su equipo de investigación, del Instituto de Investigación Walter + Eliza (Australia), estudian cómo los genes cambian entre los estados de «activo» a «durmiente». Una proteína llamada SMCHD1 mantiene muchos genes en su estado durmiente e incluyen algunos de los genes maternos que están involucrados en PWS. Se ha descubierto que si la función de SMCHD1 está bloqueada, estos genes se activarán y se volverán funcionales.
El estudio se basa en que PWS está causado por la falta de expresión de un grupo de genes normalmente expresados sólo de la copia que se hereda del padre; la copia de la madre está silenciada. El PWS se da esencialmente porque la copia del padre está ausente, pero como en las personas sanas, la copia materna está silenciada El SYS es muy similar pero el problema está en un solo gen en ese grupo. Una terapia para ambas enfermedades sería despertar la copia materna mediante la inhibición de factores que normalmente silencian estos genes en la copia materna. SMCHD1 es uno de esos factores y han demostrado en modelos de ratón funciones para desactivar el grupo de genes PWS. Por lo tanto, inhibir SMCHD1 es un nuevo tratamiento potencial para PWS y SYS.
Los datos en ratones proporcionan una esperanza en humanos. Dado que es imposible tomar muestras de células cerebrales hipotalámicas, utilizaran células derivadas de células de pacientes PWS y SYS con la capacidad de producir cualquier célula en el cuerpo. Si el proyecto tuviera éxito, el siguiente paso sería desarrollar fármacos que inhibieran la función SMCHD1.

El Dr. Michael Talkowski y su equipo, del Hospital General de Massachusetts, utilizará la tecnología CRISPR para desarrollar modelos celulares avanzados de PWS, en el que se eliminará de cada modelo celular sólo un gen de la región Prader-Willi perteneciente al cromosoma 15, para poder analizar exactamente cómo la pérdida de cada gen afecta las propiedades celulares de ese modelo específico.
Las líneas celulares desarrolladas a partir de este proyecto se depositarán en un biobanco y se pondrán a disposición de toda la comunidad de investigación de PWS.
Posteriormente se cultivarán células madre humanas para generar líneas celulares que tengan deleciones PWS. Se compararán estas células con células que son genéticamente idénticas, pero sin esas deleciones.
Específicamente, diferenciarán las células madre PWS en neuronas del hipotálamo, una región del cerebro que se considera crítica para el comportamiento anómalo en pacientes con PWS. Luego, estudiarán las propiedades celulares de estas neuronas y examinarán los niveles de expresión de todos los genes, en todos los casos comparando neuronas sin deleciones de PWS con aquellas que tienen las deleciones. Finalmente, crearán una serie de líneas celulares con deleciones de genes individuales dentro de la región de deleción PWS.
Estado actual de la investigación
En los videos de estas dos recientes conferencias, se puede obtener una visión general de la situación actual de la investigación
Principales artículos de investigación sobre el Síndrome de Schaaf-Yang

2013
Mutaciones en Magel2 como causa de los fenotipos en PWS y del autismo

2016
SYS y PWS: Enfermedades del neurodesarrollo con MAGEL2 en común

2016
Disfunción muscular causada por la pérdida de Magel2 en un modelo de ratón de PWS y SYS

2017
El espectro fenotípico del SYS: 18 nuevos afectados en 14 familias

2018
Una nueva mutación de MAGEL2 en un paciente con SYS e hipopituitarismo

2018
Síndrome de pseudo-obstrucción intestinal crónica y malrotación gastrointestinal en un lactante con SYS

2018
Fenotipo de dos pacientes polacos con SYS confirmado al identificar una mutación en MAGEL2

2018
Tres pacientes con SYS que presentan artrogriposis y anomalías endocrinológicas

2019
Trastornos relacionados con MAGEL2: un estudio y series de casos

2019
Mutaciones en MAGEL2 y L1CAM asociadas con hipopituitarismo congénito y artrogriposis

2019
La inactivación de MAGEL2 suprime oxitocina en neuronas a través del desequilibrio sináptico de excitación-inhibición

2019
SYS causado por nueva variación del gen MAGEL2

2019
SYS muestra un fenotipo similar al PWS durante la infancia

2019
Vías mtoR y autofagia desreguladas en modelos murinos y humanos del SYS

2020
Fenotipo neurocognitivo y neuroconductual de jóvenes con SYS

2020
Un complejo MAGEL2-desubiquitinasa modula la ubiquitinación de la proteína del ritmo circadiano CRY

2020
Una variante recurrente en MAGEL2 en cinco hermanos con trastornos respiratorios graves después del nacimiento

2020
Espectro fenotípico y análisis genético en los casos fatales del SYS: Informe de dos casos y revisión de la literatura

2021
SYS: un verdadero desafío en el diagnóstico prenatal

2021
El espectro del fenotipo y genotipo del Síndrome de Schaaf-Yang: una revisión de la literatura

2021
Espectro fenotípico del Síndrome de Schaff Yang: informe de un caso sobre una nueva mutación del gen MAGEL2

2021
El dominio N-terminal de la proteína MAGEL2 del SYS probablemente tiene un papel en el metabolismo del ARN

2021
Análisis retrospectivo de la terapia con hormona de crecimiento GH en niños con SYS

2021
La corrección del déficit de vasopresina en el tabique lateral mejora los déficits sociales del modelo de autismo en ratones
2021
Síndrome de Schaaf-Yang

2021
El análisis de la red cerebral de EEG para evaluar la función cognitiva en adolescentes con síndrome de microdeleción 15q13.3

2021
El impacto de la oxitocina en el crecimiento de neuritas y proteínas sinápticas en ratones con deficiencia en MAGEL2

2021
Ampliación del espectro de endocrinopatías identificadas en el SYS: Informe de un caso y revisión de la literatura
Organismos de investigación del Síndrome de Schaaf-Yang

Hospital Infantil de Texas (USA)
Dedicado a investigar el origen genético de trastornos del desarrollo neurológico y neuropsiquiátricos.

INGEMM – Instituto de Genética Médica y Molecular
Instituto de investigación orientado a los pacientes con enfermedades raras de base genética

Grupo de Genética Molecular Humana
Su investigación se centra en patologías monogénicas y enfermedades genéticas complejas.

Instituto de Genética Humana
Sus principales áreas de investigación son las enfermedades neuromusculares, el autismo y la discapacidad intelectual, los síndromes no diagnosticados y los trastornos esqueléticos.

Fundación Prader-Willi
Fundación que fomenta el avance de la investigación y el desarrollo terapéutico del Síndrome Prader-Willi y del Síndrome Schaaf-Yang.

Instituto de Neurobiología del Mediterráneo
Identifican alteraciones de neuromoduladores (hormonas, bioaminas) responsables de patologías con una variedad de síntomas: respiratorios, endocrinos, cognitivos y conductuales.

Unidad de Endocrinología Pediátrica y Dismorfología
Creada en 1980, siendo una de las primeras unidades de dicha especialidad creadas en Madrid

Unidad de Niños con Patología Compleja Crónica
Creada en 2008 para atender a niños con patología crónica altamente compleja

Ciberer Biobank
Biobanco público que centraliza la recepción de las muestras para la investigación en enfermedades raras en España.